
新型化合物可选择性杀灭脑胶质细胞瘤干细胞!
发布时间:2019-03-15 10:29 点击次数:189
全球每年有数十万人被诊断为胶质母细胞瘤,这一恶性脑肿瘤的平均存活时间仅为1年,大部患者的预后极差,难以治愈。近日来自斯克里普斯研究中心的研究人员发现了一种全新的化合物,其被称之为RIPGBM,在体外实验中其显示出相较于标准抗脑肿瘤药物40倍的药效,同时这一化合物具有极高的选择性,在杀灭胶质母细胞瘤的同时,还能保护脑组织免受破坏。这一研究的最新研究结果发表于近期的《PNAS》杂志。

目前已明确干细胞机制在多种癌症中的发生、进展和复发中发挥关键作用,而浸润性胶质母细胞瘤(GBM)也属于这一类肿瘤。对于复发性胶质母细胞瘤,即使采用积极治疗,患者的中位生存期目前仅为12-15个月。胶质母细胞瘤癌症干细胞(CSC)是首批从实体肿瘤中分离和鉴定的癌症干细胞群。这些细胞与神经干细胞(NPC)具有共同的特征,即含有NSC标记物,例如,Nestin和SOX2的表达,其具有自我更新、分化和产生神经干细胞和神经元谱系细胞的能力。胶质母细胞瘤的高度浸润性质归因于胶质母细胞瘤癌症干细胞在脑内迁移的能力,这一特征也与NSCs相关。此外,胶质母细胞瘤癌症干细胞被认为有助于癌症产生耐药性,甚至其已被证明可促进内皮细胞的形成,进而促进供给肿瘤组织血管的生成。因此,开发用于治疗GBM的治疗新策略最近集中于针对该类肿瘤的干细胞群体。
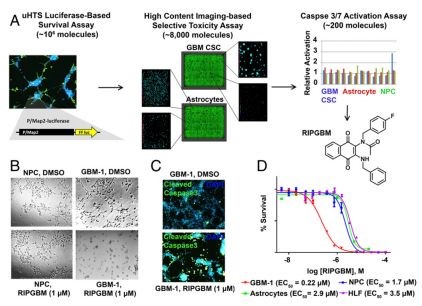
来自斯克里普斯研究中心的研究人员使用大规模筛选方法来鉴定诱导GBM CSC中细胞凋亡的药物样小分子。由于增殖性非干/多能GBM细胞的扩增种群用于此类筛选的用途十分有限,而使用培养的人肿瘤来源的GBM CSC的体外和体内临床前模型可更准确地囊括该疾病的生物学行为及其内在机制。因此,研究者通过源自患者的GBM CSC作为稳定细胞系扩增,并保持其体外分化潜能,进而对它们的体内植入,肿瘤形成和迁移潜力进行了相关研究。
经过几轮筛选后,Scripps Research化学助理教授Luke Lairson和他的同事们发现,一种名为RIPGBM的化合物在保证健康细胞不受影响的同时,能够准确杀死GBM CSC。由于他们发现胶质母细胞瘤癌症干细胞内存在较为特殊的催化酶,因此可以促使RIPGBM仅在其内发生作用,进而防止其对其他细胞的破坏。在这些肿瘤细胞中,修饰的化合物cRIPGBM会触发称为细胞凋亡的细胞自毁过程,进而杀灭肿瘤细胞。

研究人员表示,在使用人类患者衍生的胶质母细胞瘤细胞构建的标准小胶质细胞瘤模型中,未治疗的小鼠在五周内出现了常见的脑肿瘤,而RIPGBM治疗的小鼠则发展为相对微小的脑肿瘤,同时其与标准的抗GBM药物temozolomide(替莫唑胺)相比,药效要高出前者近40倍。
Lairson及其同事计划进一步开发RIPGBM,如果一切顺利,在更多的动物试验 之后,这一药物将进行最终的人体临床试验。


